Мир вокруг нас состоит из множества веществ, которые объединены в огромное количество разнообразных материалов и элементов. Металлы и неметаллы - две важные группы веществ, которые существуют в неограниченном количестве форм и состояний. Они служат строительным материалом для зданий, ингредиентами в лекарствах и используются во множестве других областей нашей жизни.
Около трех четвертей элементов в таблице Менделеева относятся к металлам - это благородные металлы, щелочные металлы, переходные металлы и другие. Неметаллы, в свою очередь, включают в себя такие элементы как водород, кислород, фтор и много других. Но чем именно отличаются атомы металлов и неметаллов? В чем их основные характеристики и какие особенности делают их настолько уникальными?
Понимание строения и свойств атомов металлов и неметаллов играет важную роль в химической науке и технологии. Например, металлы обладают хорошей электропроводностью, благодаря свободному движению электронов внутри их атомов. В то же время, неметаллы обычно образуют молекулы совместным разделением электронов, что делает их непроводящими электрический током.
Электронная конфигурация металлических и неметаллических атомов
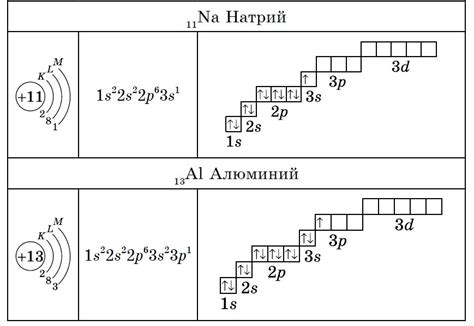
В данном разделе мы рассмотрим особенности электронного строения атомов металлических и неметаллических элементов. От электронной конфигурации атома зависят его химические свойства, способность образовывать соединения и реакционную активность. Познакомимся с основными чертами электронного строения металлов и неметаллов, их различиями и особенностями.
Металлы, в отличие от неметаллов, обладают определенными особенностями в строении атома и его электронной оболочке. Их атомы обычно имеют малое количество электронов на наружной оболочке, что обеспечивает их способность образовывать положительно заряженные ионы при вступлении в химические реакции. В свою очередь, неметаллы обладают большим количеством электронов на внешней оболочке, что обуславливает их способность образовывать отрицательно заряженные ионы или разделять свои электроны с другими атомами при образовании химических связей.
Подробно изучив электронное строение металлических атомов, мы увидим, что они определенным образом располагают свои электроны на энергетических уровнях и подуровнях, что обеспечивает их высокую проводимость и теплопроводность. Неметаллы же обладают более сложной электронной конфигурацией, из-за чего они обладают различными электрическими и химическими свойствами, такими как низкая проводимость и хрупкость.
Расположение электронов в энергетических оболочках: ключевые различия
Энергетические оболочки атомов металлов и неметаллов обладают некоторыми значительными отличиями в расположении электронов. Под "расположением электронов" понимается их упорядоченное распределение по оболочкам, определяющее свойства и характер взаимодействия атомов.
- Число электронов в каждой оболочке
- Порядок заполнения оболочек
- Влияние электронной конфигурации на свойства
Металлы обычно имеют меньшее количество электронов на своих внешних оболочках, в то время как неметаллы могут иметь полностью заполненные внешние оболочки или дополнительные электроны на таких оболочках.
Распределение электронов в энергетических оболочках металлов и неметаллов также различается. Металлы обычно заполняют свои оболочки по порядку возрастания энергии, начиная с самых низких уровней энергии. В то же время, неметаллы могут иметь особенности в заполнении оболочек, связанные с конфигурациями электронов и их взаимодействием.
Расположение электронов в оболочках сказывается на свойствах атомов. Металлы, благодаря своим характеристическим оболочкам, обладают хорошей проводимостью электричества и тепла, высокой пластичностью и другими металлическими свойствами. В то же время, неметаллы, с их более сложной электронной конфигурацией, проявляют непроводящие свойства и могут образовывать ковалентные и ионные связи.
Роль внешней оболочки в химических свойствах металлов и неметаллов
У металлов и неметаллов различное строение внешней оболочки, что приводит к существенным различиям в их химических свойствах. Для металлов характерно наличие небольшого количества электронов во внешней оболочке. Это делает металлы склонными к потере электронов и образованию положительно заряженных ионов. Благодаря этому, металлы обладают способностью проводить ток и тепло, а также образовывать ионные соединения с неметаллами, которые проявляют химическую активность.
В отличие от металлов, неметаллы обладают большим количеством электронов во внешней оболочке. Это делает неметаллы склонными к получению электронов и образованию отрицательно заряженных ионов, а также образованию ковалентных связей между атомами. Именно из-за этих химических свойств, неметаллы обычно не обладают способностью проводить ток и тепло, а сами по себе проявляют химическую активность при взаимодействии с другими веществами.
- Металлы и неметаллы имеют определенную форму и консистенцию, которые связаны с особенностями их строения.
- Внешняя оболочка атомов влияет на химические свойства вещества, определяя его реактивность и способность к взаимодействию с другими веществами.
- Строение внешней оболочки различается у металлов и неметаллов, что обусловливает их различные химические свойства.
- Металлы обладают способностью проводить ток и тепло, образовывать ионные соединения, а неметаллы - ковалентные связи и положительные ионы.
Таким образом, понимание роли внешней оболочки в химических свойствах металлов и неметаллов является важным для понимания их поведения и применения в различных областях, от металлургии до химической промышленности.
Различия в размерах атомов и ионов: особенности металлов и неметаллов

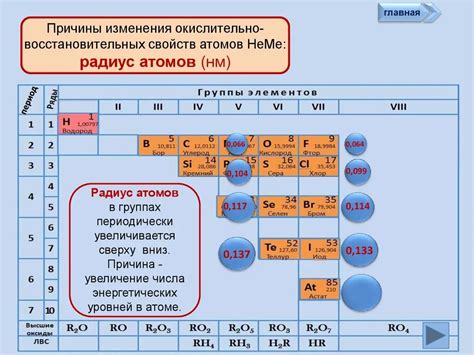
Металлы, как классические проводники электричества и тепла, обладают определенными особенностями в строении своих атомов и ионов. Они характеризуются большими атомными радиусами, что означает, что атомы металлов имеют больший размер по сравнению с атомами неметаллов. Это связано с особенностями расположения электронов в электронных оболочках.
- Наиболее близким к ядру располагается электронная оболочка, называемая валентной оболочкой. Она играет ключевую роль в химических свойствах металлов и неметаллов.
- Благодаря большим размерам атомов, металлы обладают свободными электронами, которые могут свободно перемещаться в кристаллической решетке, обеспечивая электрическую проводимость.
- Ионарные радиусы металлов также больше, чем у неметаллов, что связано с процессом ионизации. Поэтому ионы металлов имеют больший размер в сравнении с ионами неметаллов.
В свою очередь, неметаллы отличаются от металлов не только сводимостью к проводимости, но и размерами своих атомов и ионов. Атомные радиусы неметаллов меньше, если сравнивать их с атомными радиусами металлов. Это связано с особенностями расположения электронов в электронных оболочках неметаллов и их меньшим размером.
- Валентные оболочки атомов неметаллов отличаются от валентных оболочек атомов металлов и влияют на их химические свойства.
- Неметаллы обычно образуют полностью или частично заполненные оболочки электронами, что делает их стабильными и непроводящими электричество.
- Ионарные радиусы неметаллов также меньше, чем у металлов, и это связано с процессом образования ионов.
Таким образом, различия в размерах атомов и ионов являются одним из основных отличий между металлами и неметаллами. Понимание этих особенностей позволяет лучше понять строение и свойства веществ в зависимости от их классификации.
Особенности химических связей между металлами и неметаллами

В данном разделе рассмотрим особенности образования химических связей у металлических и неметаллических элементов, фокусируясь на их различиях.
Химические связи в металлах и неметаллах являются ключевыми факторами, определяющими их химические и физические свойства, а также их поведение в различных химических реакциях. Однако, процессы образования этих связей в металлах и неметаллах имеют важные отличия.
Когда речь идет о металлах, химическая связь возникает благодаря особому электронному строению. Металлические элементы имеют малую электроотрицательность и склонны отдавать свои валентные электроны. Этот процесс создает электронное "море" - облако электронов, которое формирует металлическую связь. Данная связь обладает характеристиками подвижности и металлической проводимости.
В отличие от металлов, неметаллы имеют высокую электроотрицательность и сильную способность притягивать электроны. Как результат, химическая связь у неметаллов основана на образовании ковалентных или ионных связей. Ковалентная связь образуется при совместном использовании электронов двумя атомами неметалла. Ионные связи, в свою очередь, образуются при передаче электронов от одного атома неметалла другому.
Таким образом, особенности образования химических связей у металлов и неметаллов основаны на различии в их электронных свойствах. Изучение данных различий позволяет лучше понять причины различных химических свойств и реакций этих элементов и расширить наши знания о строении и поведении атомов металлов и неметаллов.
Взаимосвязь строения атомов с физическими характеристиками веществ

Физические свойства металлов и неметаллов в значительной мере определяются особенностями строения атомов, которые составляют эти вещества. Под строением атомов понимается их внутреннее устройство и взаимное расположение частиц. Различия в строении атомов металлов и неметаллов обусловливают разные физические свойства этих двух классов веществ.
В металлах атомы образуют кристаллическую решетку, в которой положительно заряженные ядра атомов располагаются регулярно и взаимодействуют с общей электронной оболочкой. Кристаллическая структура обеспечивает металлам такие свойства, как высокая теплопроводность, электропроводность и пластичность. Благодаря возможности электронов свободно передвигаться по решетке, металлы обладают хорошей электропроводностью и высокой теплопроводностью.
В отличие от металлов, неметаллы образуют ковалентную или ионную связь между атомами. В ковалентной связи электроны общаются между собой, образуя пары электронов, которые облегчают обмен энергией. Это свойство позволяет неметаллам образовывать многообразие структур и составов веществ. Неметаллы также могут образовывать ионные связи, при которых происходит передача электронов от одного атома к другому. Это приводит к образованию ионов разного заряда и обусловливает такие свойства неметаллов, как высокая электроотрицательность, различные степени окисления и возможность образования кислотных оксидов.
| Физические свойства металлов | Физические свойства неметаллов |
|---|---|
| Высокая теплопроводность | Низкая теплопроводность |
| Высокая электропроводность | Низкая электропроводность |
| Пластичность и деформируемость | Хрупкость и недеформируемость |
В итоге, строение атомов металлов и неметаллов оказывает существенное влияние на их физические свойства. Кристаллическая структура металлов обеспечивает высокую тепло- и электропроводность, атомы неметаллов с ковалентными и ионными связями обладают низкой проводимостью и более сложными химическими свойствами. Понимание этой взаимосвязи позволяет более глубоко изучать и объяснять различные физические и химические характеристики данных веществ.
Вопрос-ответ

Вопрос
Ответ
Какие основные отличия в строении атомов металлов и неметаллов?
Строение атомов металлов и неметаллов основано на различии в электронной структуре. У атомов металлов на внешнем энергетическом уровне находится мало электронов, что делает их склонными к отдаче электронов и образованию ионов положительного заряда. У атомов неметаллов на внешнем уровне находится много электронов, что делает их склонными к приему электронов и образованию ионов отрицательного заряда.
Какие свойства металлов и неметаллов определяются их строением атомов?
Строение атомов металлов и неметаллов определяет их химические и физические свойства. У металлов благодаря отсутствию или низкому количеству электронов на внешнем энергетическом уровне, они обладают высокой электропроводностью, теплопроводностью, пластичностью и блеском. Неметаллы, напротив, благодаря наличию множества электронов на внешнем уровне, обладают низкой электропроводностью, теплопроводностью и ломкостью.
Какие элементы относятся к металлам, а какие к неметаллам?
К металлам относятся элементы, у которых на внешнем энергетическом уровне находится от одного до трех электронов. Это, например, железо, медь, алюминий. К неметаллам относятся элементы, у которых на внешнем энергетическом уровне находится пять, шесть или семь электронов. Примерами неметаллов являются кислород, азот, хлор.
Можно ли объяснить различия в строении атомов металлов и неметаллов с помощью периодической таблицы?
Да, периодическая таблица в большой степени объясняет различия в строении атомов металлов и неметаллов. В периодической таблице элементы располагаются в порядке возрастания атомного номера. По этому порядку можно определить количество электронов на внешнем энергетическом уровне. Так, металлы находятся слева и по середине таблицы, а неметаллы расположены справа.



