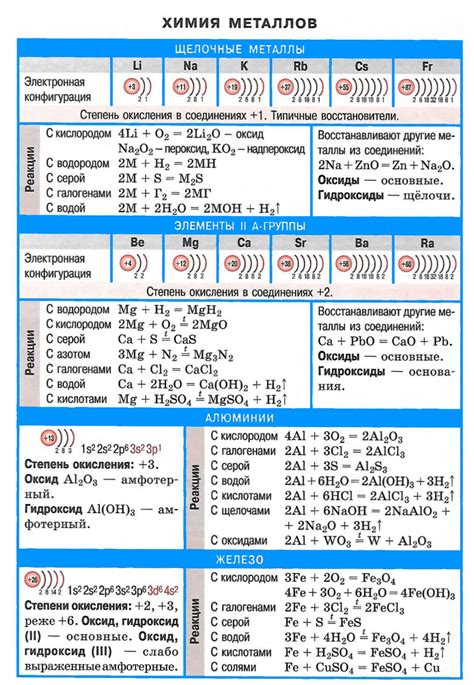
Щелочные металлы – это группа элементов, которая включает в себя литий, натрий, калий, рубидий, цезий и франций. Они являются наиболее активными металлами в периодической системе и имеют высокую химическую реактивность.
Важнейшие соединения щелочных металлов обладают различными свойствами и находят применение в различных областях науки и промышленности.
Например, соединения лития применяются в производстве лекарственных препаратов и аккумуляторов. Натрий является составной частью многих минералов, а его гидроксид (щелочь) используется в мыловарении и в производстве бумаги. Калий находит применение в производстве удобрений, а гидроксид калия используется в мыловарении и в процессе получения стекла.
Рубидий, цезий и франций являются редкими элементами и находят применение в научных исследованиях и разработках. Также они используются в производстве высокоточной аппаратуры и ядерных реакторов.
Таблица основных соединений щелочных металлов
Щелочные металлы представляют собой группу элементов, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы обладают высокой химической активностью и вступают в реакцию с водой, кислородом и другими веществами.
Соединения щелочных металлов имеют широкое применение в различных областях науки и промышленности. В таблице представлены некоторые основные соединения щелочных металлов:
| Щелочные металлы | Соединение | Химическая формула |
|---|---|---|
| Литий | Лития гидрид | LiH |
| Натрий | Гидроксид натрия | NaOH |
| Калий | Калия перманганат | KMnO4 |
| Рубидий | Рубидия гидроксид | RbOH |
| Цезий | Цезия хлорид | CsCl |
| Франций | Франция нитрат | Fr(NO3)2 |
Эти соединения используются в процессе производства различных продуктов, в химической и фармацевтической промышленности, а также в научных исследованиях в области химии и материаловедения. Знание основных соединений щелочных металлов позволяет более глубоко изучить и понять свойства этих элементов и их применение в различных областях жизни.
Соединения лития

Литий является щелочным металлом и образует различные соединения с разными элементами. Одно из наиболее известных и широко используемых соединений лития - это литиевая соль, которая имеет химическую формулу LiCl.
Кроме того, литий образует соединение с кислородом под названием литиевый оксид (Li2O). Этот соединение является белым кристаллическим веществом, химически активным и используется в различных областях, включая производство литиевых батарей.
Одним из интересных соединений лития является литиевая смазка. Оно состоит из литиевого мыла (LiC18H35O2), которое образуется из реакции лития с жирными кислотами. Литиевая смазка обладает высокой степенью стойкости при высоких температурах и широко используется в автомобильной промышленности и часовом производстве.
Кроме того, литий образует различные соединения с другими элементами, такими как сера (Li2S), фтор (LiF), бром (LiBr), йод (LiI) и др. Многие из этих соединений также имеют практическое применение, например, литий-йодные батареи используются в медицинской и оптической технике.
Соединения натрия
Натрий – щелочной металл, который обладает химическим символом Na и атомным номером 11 в таблице Менделеева. Натрий является одним из важнейших элементов в химии благодаря своей реактивности и широкому использованию.
Одним из наиболее распространенных соединений натрия является натриевый хлорид (NaCl). Это бесцветные кристаллы, хорошо растворимые в воде. Натриевый хлорид широко используется в пищевой промышленности в качестве пищевой соли и является важным компонентом нашей дневной дозы натрия. Он также используется в медицине в качестве лекарственного средства для поддержания нормальной концентрации натрия в организме.
Другим важным соединением натрия является натриева карбоната (Na2CO3), более известная как пищевая или сода. Натриева карбоната широко применяется в производстве стекла, моющих средств и в качестве ингредиента в выпечке. Она также используется в обработке воды для мягчения жесткой воды.
Кроме того, натрий образует соединения с другими элементами, такие как натриев гидроксид (NaOH), натриев калий тартрат (NaKC4H4O6) и натриев гидрокарбонат (NaHCO3), которые также имеют широкое применение в различных областях, включая химическую промышленность, медицину и пищевую промышленность.
Соединения калия
Карбонат калия (K2CO3) - бесцветные кристаллы или белый порошок. Является основным компонентом промышленных моек, моющих средств и стекольного сырья. Также широко используется в производстве стекла, мыле и щелочных аккумуляторах. Карбонат калия применяется в сельском хозяйстве в качестве удобрения.
Гидроксид калия (KOH) - белые кристаллы или желтоватая масса. Широко применяется в различных сферах, включая производство мыла, бумаги, ткани и стекла. Гидроксид калия также используется в качестве основного ингредиента в электролите для щелочных аккумуляторов и в лабораторных условиях для нейтрализации кислот.
Хлористый калий (KCl) - бесцветные кристаллы или белый порошок. Применяется в медицине в качестве препарата для коррекции недостатка калия в организме. Также используется в сельском хозяйстве в качестве удобрения. Хлористый калий используется в производстве стекла и пластмасс, а также в нефтедобыче для усиления обводненности нефти.
Нитрат калия (KNO3) - белые кристаллы или белый порошок. Применяется в пиротехнике для изготовления фейерверков и петард, а также в садоводстве в качестве удобрения. Нитрат калия используется в медицине для лечения ангины и других заболеваний, связанных с бактериальной инфекцией.
Калий является одним из наиболее распространенных щелочных металлов и образует множество соединений. Описанные выше соединения калия являются лишь некоторыми из них и наиболее важными с точки зрения промышленного применения. Знание свойств и применения этих соединений важно для понимания химических процессов, происходящих в природе и промышленности.
Соединения рубидия

Рубидий – щелочной металл, принадлежащий к группе I периодической системы химических элементов. У рубидия имеются различные соединения, которые находят применение в различных областях науки и техники.
Оксид рубидия (Rb2O) – бесцветное вещество, образующее бинарные системы со многими другими веществами. Он является сильным основанием и способен реагировать с кислородом. Оксид рубидия используется в различных процессах синтеза и получении металлов.
Соединение рубидийхлорид (RbCl) является солью. Оно образуется в реакции рубидия с хлоридами кислот. Рубидийхлорид применяется в химическом анализе и в качестве источника рубидия в некоторых процессах.
Соединение рубидийгидроксид (RbOH) – одно из самых важных соединений рубидия. Оно является сильным основанием и используется в аналитической химии. Рубидийгидроксид также является важным компонентом в процессе получения других рубидиевых соединений.
Важным соединением рубидия является его карбид (Rb2C2). Он представляет собой твердое вещество, образующееся при взаимодействии рубидия с углеродом. Карбид рубидия широко применяется в процессах получения различных органических соединений.
Перманганат рубидия (RbMnO4) – соль, которая образуется при взаимодействии рубидия с перманганатом калия. Это ярко-фиолетовое вещество, которое находит применение в аналитической химии, в процессе окисления органических соединений и в качестве окислителя в различных реакциях.
Соединения цезия

Цезий (Cs) - щелочной металл, который образует различные соединения с другими элементами. Одним из наиболее известных соединений цезия является цезий хлорид (CsCl). Это белый кристаллический порошок, растворяющийся в воде. Цезий хлорид используется в медицине и научных исследованиях в качестве образца для измерения активности радионуклидов.
Еще одним важным соединением цезия является цезий фосфат (Cs3PO4). Это бесцветные кристаллы, которые используются в качестве катализаторов в химических реакциях. Цезий фосфат также используется в производстве стекла и керамики.
Цезий может также образовывать соединения с другими элементами, такими как оксиды, пероксиды и сульфиды. Например, цезий оксид (Cs2O) используется в качестве катализатора в органическом синтезе, а цезий сульфид (Cs2S) применяется в световых приборах и электронных устройствах.
Соединения цезия широко используются в различных областях, от медицины до электроники. Изучение и понимание свойств этих соединений имеет важное значение для развития науки и технологии.
Вопрос-ответ

Какие вещества входят в таблицу важнейших соединений щелочных металлов?
В таблицу входят гидроксиды, карбонаты, гидрокарбонаты, сульфаты, нитраты и хлориды щелочных металлов.
Зачем нужна таблица важнейших соединений щелочных металлов?
Таблица помогает систематизировать знания о химических свойствах щелочных металлов и их соединений. Она содержит информацию о составе и свойствах соединений, а также о применении этих соединений в различных областях науки и техники.
