Хлороводородная кислота (HCl) является одной из наиболее распространенных и хорошо изученных кислот. Ее взаимодействие с оксидами металла является важным объектом исследования в области химии. При этом существует ряд основных реакций и свойств, которые играют ключевую роль в понимании процессов химического взаимодействия.
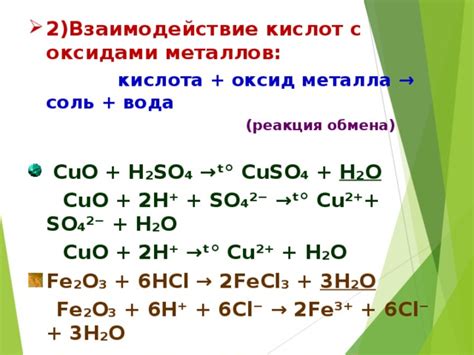
Одной из основных реакций, которую проявляет HCl при взаимодействии с оксидами металла, является образование соли и воды. Например, в результате взаимодействия HCl с оксидом железа (Fe2O3) образуется соль хлорида железа (FeCl2) и вода (H2O). Такая реакция происходит в результате образования кислотного оксида (H2O) и соли металла.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Кроме того, хлороводородная кислота проявляет свойства окислителя при взаимодействии с оксидами металла. Например, с оксидом меди (CuO) происходит реакция, в результате которой медь окисляется до оксида меди (CuO), а кислород восстанавливается.
2HCl + CuO → CuCl2 + H2O
Таким образом, взаимодействие HCl с оксидами металла имеет как кислотные, так и окислительные свойства, что обусловливает разнообразные реакции и формирование различных продуктов. Данные реакции и свойства становятся основой для изучения процессов химического взаимодействия и находят применение в различных областях, включая синтез химических соединений и промышленные процессы.
Химическое взаимодействие HCl с оксидами металла
Хлорид водорода (HCl) – химическое вещество, которое образуется при взаимодействии хлора (Cl) с водородом (H). При контакте с оксидами металла, HCl может вызывать различные реакции и проявлять определенные свойства.
Реакции HCl с оксидами металла зависят от химических свойств каждого конкретного оксида. Например, с щелочными оксидами (Na2O, KO) HCl реагирует, образуя соль и воду:
- 2HCl + Na2O → 2NaCl + H2O
- 2HCl + KO → 2KCl + H2O
С другими оксидами металла – переходными (Fe2O3, CuO) или амфотерными (Al2O3, ZnO) – реакция HCl протекает по-разному. Некоторые оксиды, например, Fe2O3, реагируют с HCl, образуя хлорид металла и воду:
- HCl + Fe2O3 → FeCl3 + H2O
Другие оксиды, например, CuO, не реагируют непосредственно с HCl, но при нагревании их смеси может возникать реакция:
- 3HCl + CuO → CuCl2 + H2O
Свойства реакции HCl с оксидами металла могут быть различными, в зависимости от условий и среды. Протекание реакции может быть сопровождено выделением тепла, изменением цвета или состояния вещества, образованием ионов и т.д. Также, степень реакции HCl с оксидами металла может зависеть от концентрации и температуры реагентов.
Взаимодействие HCl с оксидами металла – это важный процесс, который может применяться в различных химических и промышленных процессах. Понимание этих реакций и свойств помогает расширить знания о химических взаимодействиях и использовании реактивов в химии и технологии.
Основные реакции
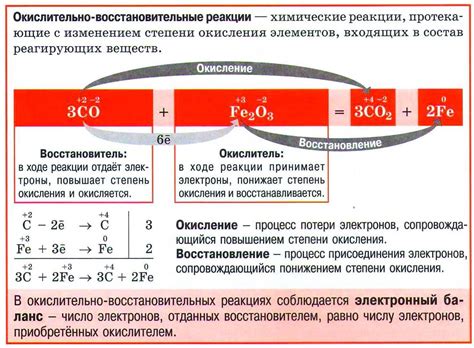
HCl (соляная кислота, хлороводородная кислота) – сильная двухосновная кислота, которая реагирует с оксидами металла, образуя соли и воду. Основные реакции взаимодействия HCl с оксидами металла включают образование хлорида металла и выделение воды.
Реакция с оксидом натрия (Na2O):
- 2HCl + Na2O → 2NaCl + H2O
Реакция с оксидом алюминия (Al2O3):
- 6HCl + Al2O3 → 2AlCl3 + 3H2O
Реакция с оксидом кальция (CaO):
- 2HCl + CaO → CaCl2 + H2O
Реакция с оксидом железа (Fe2O3):
- 6HCl + Fe2O3 → 2FeCl3 + 3H2O
Реакция с оксидом меди (CuO):
- HCl + CuO → CuCl2 + H2O
Также следует отметить, что HCl взаимодействует с оксидами металла с образованием хлористого аниона и ионов металла в растворе. Полученные соли можно использовать в различных областях, например, в промышленности, пищевой промышленности и медицине.
Свойства
Хлороводородная кислота (HCl) является одной из наиболее распространенных кислот, обладающей рядом характерных свойств. Она является безцветной газообразной или хлористым кислотным раствором. Хлороводородная кислота обладает сильной кислотностью и может вызывать ожоги при контакте с кожей.
Сочетание веществ. HCl способна реагировать с различными соединениями, включая оксиды металлов. При контакте с оксидами металлов образуется соль и вода. Реакция идет следующим образом: HCl + оксид металла → соль + вода.
Реакция HCl с основаниями. Хлороводородная кислота также может реагировать с щелочами или основаниями, образуя соль и воду. Такая реакция называется нейтрализацией. В результате нейтрализации образуется соль и вода. Реакция HCl + NaOH → NaCl + H2O.
Кислотные свойства. HCl обладает кислотными свойствами, что значит, что она способна отдавать протоны. Это позволяет ей эффективно реагировать с различными соединениями и выполнять различные функции в химических процессах.
Физические свойства. Хлороводородная кислота обладает высокими температурой кипения и плавления. Она хорошо растворима в воде и образует сильные электролитические растворы. Также, она обладает характерным запахом и может вызывать раздражение слизистых оболочек при попадании паров в организм.
Металлокомплексы
Металлокомплексы представляют собой химические соединения, состоящие из металла, называемого центральным атомом, и определенного числа лигандов, которые образуют с металлом ковалентные или ионные связи. Лиганды являются атомами, ионами или молекулами, которые обладают непарными электронами и способны координироваться с металлом.
Металлокомплексы обладают рядом уникальных свойств. Во-первых, они могут быть очень стабильными и устойчивыми к различным воздействиям, таким как изменение температуры или добавление других веществ. Во-вторых, металлокомплексы обладают специфичными химическими и физическими свойствами, которые определяют их реакционную активность, способность образовывать соединения различной степени окисления и катализировать химические реакции.
Металлокомплексы широко применяются в различных областях, включая катализ, медицину, электронику и синтез органических соединений. Например, металлокомплексы используются в катализаторах для ускорения реакций и снижения энергетических затрат, а также в лекарствах для лечения различных заболеваний, таких как рак. Кроме того, некоторые металлокомплексы обладают магнитными свойствами и применяются для создания магнитных материалов и устройств.
Влияние на окружающую среду

Химическое взаимодействие хлороводорода (HCl) с оксидами металла может оказывать значительное влияние на окружающую среду. При реакции HCl с оксидом металла образуется хлорид металла и вода. Такие реакции могут происходить в промышленных и хозяйственных процессах, а также при сжигании топлива и отходов.
Высокая концентрация хлороводорода в воздухе может быть опасной для растений, животных и человека. HCl может вызывать раздражение слизистых оболочек органов дыхания и глаз, а также вызывать проблемы с дыханием. При попадании HCl в почву оно может повлиять на ее кислотность и свойства, что может негативно сказаться на росте и развитии растений.
Кроме того, окисление металлических оксидов HCl освобождает хлор, который может выделяться в окружающую среду. Хлор является сильным окислителем и может оказывать негативное воздействие на окружающую природу. Например, он может способствовать разрушению озонового слоя и приводить к образованию аллергенных и токсичных веществ.
Для снижения влияния реакций HCl с оксидами металла на окружающую среду необходимо проводить контроль и регулирование выбросов и расходов данных веществ. Важно также использовать современные методы очистки отходов и мониторинга состояния окружающей среды, чтобы минимизировать негативное воздействие этих процессов на окружающую среду и здоровье людей.
Вопрос-ответ

Каково химическое взаимодействие HCl с оксидами металла?
Химическое взаимодействие HCl с оксидами металла осуществляется путем образования солей и воды. При этом, оксид металла реагирует с HCl, образуя хлорид металла и воду.
Какие реакции происходят между HCl и оксидами металла?
В результате взаимодействия HCl с оксидами металла возможны две основные реакции. Первая реакция - образование соли металла и воды: HCl + MO -> MCl + H2O, где M - металл. Вторая реакция - образование хлорида металла и воды: HCl + M2O -> 2MCl + H2O.
Какие свойства проявляет хлорид металла при взаимодействии с HCl?
Хлорид металла, образующийся при взаимодействии HCl с оксидами металла, обладает следующими свойствами. Прежде всего, это твердое вещество, которое имеет высокую плотность. Оно также обладает высокой температурой плавления и кипения. Кроме того, хлорид металла обычно растворим в воде.
Какие еще реакции могут произойти при взаимодействии HCl с оксидами металла?
Помимо образования солей и хлоридов металла, при взаимодействии HCl с оксидами металла могут произойти и другие реакции. Например, возможно образование кислорода и воды при высокой температуре: 4HCl + MnO2 -> MnCl2 + 2H2O + Cl2. Также возможно образование оксида металла и воды: 2HCl + CuO -> CuCl2 + H2O.
