Кислоты и металлы обладают разными свойствами и химическими реакциями, но в то же время, их взаимодействие может приводить к образованию новых соединений. Эти соединения могут иметь различные свойства и применения, и изучение их образования является важной задачей в химии.
Кислоты - это химические соединения, которые обладают способностью отдавать протоны (водородные ионы), а металлы - это элементы, которые обладают способностью отдавать электроны. При взаимодействии кислот с металлами происходит обмен элементов: кислота отдает протоны, а металл отдает электроны.
В результате этого обмена образуются новые соединения, которые имеют иные свойства. Например, при взаимодействии соляной кислоты (HCl) с металлом железом (Fe) образуется соединение феррихлорид (FeCl3). Феррихлорид обладает ярко выраженным кислотным вкусом и является красновато-желтым кристаллическим веществом.
Взаимодействие кислот и металлов
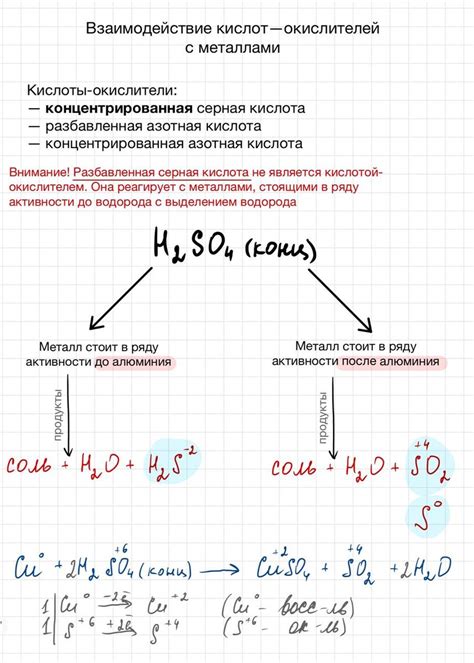
Кислоты и металлы — это две взаимодействующие группы химических веществ. Кислоты относятся к классу соединений, обладающих кислотными свойствами, тогда как металлы являются элементами, обладающими металлическими свойствами. Их взаимодействие может приводить к образованию различных соединений. Одним из наиболее распространенных видов реакций кислот с металлами является окислительно-восстановительная реакция.
В результате взаимодействия кислоты с металлами происходит образование солей и выделение водорода. При этом, металлы, как правило, выступают в роли восстановителей, а кислоты — в роли окислителей. Во время реакции окисления металлов восстанавливаются, а ионы металла образуют соль, а ионы водорода выделяются в виде газа.
Реакция кислоты с металлом может быть представлена следующим уравнением реакции:
Металл + кислота → солевой комплекс + водород
Также, результатом реакции между кислотой и металлом может быть образование оксида металла и воды. В этом случае уравнение реакции будет иметь вид:
Металл + кислота → оксид + вода
Такие реакции взаимодействия кислот и металлов широко используются в различных областях, например, в процессе получения водорода или производства солей.
Некоторые кислоты, такие как серная кислота и соляная кислота, обладают достаточно агрессивными свойствами и могут вызывать коррозию металлов. Поэтому при работе с такими кислотами необходимо соблюдать все меры безопасности и использовать соответствующую защитную экипировку.
Кислоты и их свойства

Кислоты являются важными химическими соединениями, которые обладают свойством отдавать протоны. Это означает, что они способны образовывать положительно заряженные ионы, которые взаимодействуют с другими веществами.
У кислот имеется несколько характерных свойств. Одно из них - кислотные соединения реагируют с металлами. При этом образуются соли и выделяется водород. Например, соляная кислота (HCl) взаимодействуя с металлом цинка, образует хлорид цинка и выделяет водородный газ.
Кроме того, кислоты могут реагировать с основаниями, образуя соли и воду. Это называется нейтрализацией. Например, при взаимодействии серной кислоты (H2SO4) с гидроксидом натрия (NaOH) образуется сульфат натрия (Na2SO4) и вода.
Одна из важных характеристик кислот - их кислотность. Она определяется концентрацией водородных ионов в растворе. Кислоты могут быть сильными или слабыми, в зависимости от способности отдавать протоны. Сильные кислоты, такие как соляная кислота и серная кислота, отдают протоны с легкостью, позволяя образовывать более стабильные ионы.
Кислоты имеют широкий спектр применения в различных областях, включая промышленность, медицину и сельское хозяйство. Они используются для производства удобрений, пластмасс, красителей и многих других продуктов. Кислоты также играют важную роль в биологических процессах организма, таких как пищеварение и обмен веществ.
Металлы и их свойства

Металлы - это класс материалов, обладающих рядом характерных свойств, которые их отличают от других классов веществ. Одним из основных свойств металлов является отличная тепло- и электропроводность. Благодаря этому свойству металлы широко используются в электротехнике, проводниковых материалах и промышленности.
Другим важным свойством металлов является их высокая пластичность и формоватеольность. Металлы могут быть легко подвержены деформации, что позволяет создавать из них различные изделия и конструкции. Также благодаря своей пластичности металлы способны выдерживать большие нагрузки, что делает их идеальными материалами для строительства и машиностроения.
Металлы обладают высокой прочностью и твердостью. Они могут выдерживать большие механические нагрузки и не ломаются при ударах или деформациях. Благодаря этому свойству металлы широко применяются в производстве инструментов, механизмов и металлоконструкций.
Еще одним важным свойством металлов является их способность сохранять магнитные свойства. Некоторые металлы являются магнитными и могут притягиваться к магнитам. Это свойство позволяет использовать металлы в производстве магнитооборудования, компасов и магнитов.
Таким образом, металлы обладают рядом выдающихся свойств, которые делают их незаменимыми в различных областях промышленности и науки. Их высокая проводимость, пластичность, прочность и магнитные свойства делают металлы востребованными материалами для создания разнообразных изделий и конструкций.
Соединения, образующиеся при взаимодействии кислот и металлов
Взаимодействие кислот с металлами приводит к образованию различных соединений, которые представляют собой соли. Эти соединения имеют важное применение в различных областях науки и техники.
Когда кислоты вступают в реакцию с металлами, образуются соли, которые состоят из катионов металла и анионов кислоты. Например, при реакции хлороводородной кислоты с натрием образуется хлорид натрия (NaCl), а при реакции серной кислоты с медью образуется сульфат меди (CuSO4).
Важно отметить, что реактивность металлов различна. Некоторые металлы, такие как натрий и калий, реагируют с кислотами очень быстро и глубоко, образуя обильные выделения газа. Другие металлы, такие как железо и алюминий, реагируют медленнее и не столь интенсивно.
Образующиеся при взаимодействии кислот и металлов соли имеют различные свойства и применение. Например, многие из них являются хорошими проводниками электричества и применяются в электротехнике. Другие соли используются в производстве удобрений для сельского хозяйства. Кроме того, они могут быть использованы в качестве катализаторов в химической промышленности.
Вопрос-ответ

Какие соединения образуются при взаимодействии кислоты и металла?
Взаимодействие кислоты и металла может привести к образованию соли и выделению водорода. Конкретное соединение, которое образуется, зависит от конкретных кислоты и металла, взаимодействующих между собой.
Какие примеры соединений можно привести?
Например, при взаимодействии серной кислоты (H2SO4) и цинка (Zn) образуется соль сернокислого цинка и выделяется водород. Формула этой соли ZnSO4. При взаимодействии соляной кислоты (HCl) и натрия (Na) образуется соль хлорида натрия (NaCl), а также выделяется водород.
Как происходит взаимодействие между кислотой и металлом?
Взаимодействие между кислотой и металлом происходит в результате реакции окисления-восстановления. Кислота окисляет металл, передавая ему электроны, и сама восстанавливается. Это приводит к образованию соли и выделению водорода.
Можно ли использовать подобные реакции в повседневной жизни?
Да, подобные реакции кислот с металлами имеют практическое применение. Например, в популярной домашней химической опыте можно использовать взаимодействие соды и уксусной кислоты с алюминием для создания эффекта "газового взрыва" с выделением водорода. Также, некоторые металлы, образуя соли с кислотами, применяются в различных отраслях промышленности и медицины.
