В химии железо является одним из самых распространенных элементов. Оно обладает разнообразными свойствами, которые обусловлены типами химической связи, присутствующими в его структуре. Главными типами связи в железе являются ионная, ковалентная и металлическая.
Ионная связь в железе возникает между атомами железа и другими элементами, которые могут отдонорить или принять электроны. Атомы железа могут электронно связываться с отрицательно заряженными атомами, образуя ионы железа с положительным зарядом. Такая связь обычно является сильной и имеет высокую энергию связи.
Ковалентная связь в железе возникает между атомами железа и другими атомами, которые имеют неспаренные электроны. В результате обмена электронами, образуется общая область, в которой электроны общей пары находятся. Такие связи являются сильными и обычно имеют высокую энергию связи.
Металлическая связь в железе является основной причиной его металлических свойств, таких как хорошая электропроводность и теплопроводность. В металлической связи электроны валентной области атомов железа образуют электронное облако, которое свободно перемещается по всей структуре металла. Такая связь обладает низкой энергией связи и может быть слабой или средней силы.
Что такое химическая связь?

Химическая связь - это процесс образования вещества путем объединения атомов или ионов. Она возникает вследствие взаимодействия электронов на внешней оболочке атомов и определяет химические свойства вещества. Химическая связь может быть различных типов, включая ионную, коэвалентную и металлическую связи.
Ионная связь образуется между двумя атомами, когда один атом передает один или несколько электронов другому атому. В результате образуется положительный и отрицательный ион, притягивающиеся друг к другу и формирующие структуру кристаллической решетки. Ионная связь типична для химических соединений с сильными различиями в электроотрицательности атомов.
Ковалентная связь возникает, когда два атома делят электронную пару между собой. Атомы образуют общую оболочку электронов и таким образом стабилизируют свои энергетические состояния. Ковалентная связь может быть полярной и неполярной в зависимости от разности электроотрицательности атомов. Она характерна для молекул и более сложных соединений.
Металлическая связь возникает между атомами металлов. В этом случае свободные электроны с общей электронной оболочки атомов металла могут свободно передвигаться внутри кристаллической решетки. Это обладает электропроводностью металлов и способствует их характерным металлическим свойствам, таким как гибкость, блеск и теплопроводность.
Химическая связь в железе
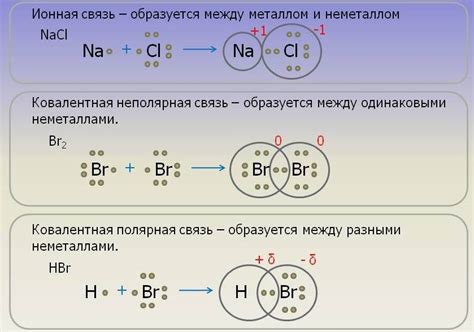
Железо – химический элемент, относящийся к группе переходных металлов. Оно обладает различными типами химической связи, которые определяют его уникальные свойства и способности.
В железе присутствуют ионные связи. Это связи, основанные на притяжении положительно и отрицательно заряженных ионов. В случае железа, положительным ионом является двухвалентный ион Fe2+, а отрицательный ион может быть, например, оксидным (O2-) или гидроксидным (OH-). Ионные связи обуславливают образование соединений, таких, как железо(II) оксид (FeO) или железо(III) гидроксид (Fe(OH)3).
Наиболее характерной связью для железа является ковалентная связь. Ковалентная связь возникает при совместном использовании электронов атомами, в результате чего возникает общая электронная пара. В железе, ковалентная связь проявляется в образовании железоуглеродных соединений, таких, как железо(II) карбонат (FeCO3) или железо(III) оксид (Fe2O3).
Необходимо отметить также металлическую связь, присутствующую в железе. Металлическая связь возникает при обмене свободными электронами атомов металла соседними атомами. В результате получается сильная, трехмерная сеть электронов, образующая кристаллическую решетку металла. В железе, металлическая связь обеспечивает его металлические свойства, такие, как высокая электропроводность и пластичность.
Ионная связь в железе

Ионная связь в железе является одним из основных видов химической связи, который происходит между атомами железа и другими атомами или группами атомов. В процессе образования ионной связи, один или несколько электронов переходят с одного атома на другой. В железе, ионная связь может происходить между атомами железа и атомами других элементов, таких как кислород, сера или азот.
Ионная связь в железе имеет свои характерные свойства. Например, она обладает высокой прочностью и твердостью, что делает железо одним из самых прочных и твердых материалов. Кроме того, ионная связь способствует образованию кристаллической структуры железа, что придает ему определенную форму и упорядоченность.
Образование ионной связи в железе может происходить по разным механизмам. Например, железо может получить положительный заряд, если оно отдает один или несколько электронов другому атому. В этом случае, атом железа становится ионом железа Fe+, а атом, который получил эти электроны, становится отрицательным ионом, например, кислородным ионом O-. Образование таких ионных связей возможно благодаря свойствам электронного строения атомов железа и других элементов, таких как электроотрицательность и размеры атомов.
Ковалентная связь в железе
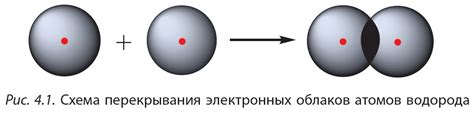
Ковалентная связь - это вид химической связи, основанной на общем использовании электронных пар атомами, чтобы образовать самосогласованное общее электронное облако. В железе ковалентная связь играет важную роль в стабилизации его структуры и свойств.
Железо (Fe) образует ковалентные связи, когда его атомы обменивают электроны с другими атомами, создавая так называемые "железные связи". Железные связи обеспечивают прочность и устойчивость структуры железа.
Ковалентные связи в железе проявляются в особенностях его физических и химических свойств. Например, благодаря ковалентной связи железо обладает высокой температурой плавления (1538 °C) и высокой твердостью. Ковалентные связи также обуславливают способность железа к образованию различных соединений с другими элементами, такими как кислород, сера и углерод.
Металлическая связь в железе

Металлическая связь – это тип химической связи, характерный для металлов, включая железо. В металлической связи электроны общаются между атомами металла, образуя так называемое "электронное облако".
Железо, как и другие металлы, обладает способностью образовывать металлическую связь благодаря своей структуре. В кристаллической решетке железа атомы расположены регулярно и образуют решетку, где свободные электроны могут двигаться свободно во всем объеме металла.
Металлическая связь обеспечивает такие характеристики металлов, как хорошая теплопроводность, электропроводность, пластичность и прочность. Благодаря этой связи между атомами, железо обладает высокой твердостью и способностью подвергаться деформации без разрушения.
Металлическая связь является одной из причин, почему железо широко используется в различных отраслях промышленности. Он находит применение в производстве стальных конструкций, автомобилей, электроники, бытовой техники и многих других областях.
Примеры химической связи в железе
Железо является одним из самых распространенных элементов на Земле. Оно имеет многочисленные применения в промышленности и быту. Одной из основных характеристик железа является его способность образовывать различные типы химической связи.
Ионная связь является одним из типов химической связи, которая возникает между положительно и отрицательно заряженными ионами. Примером ионной связи в железе может служить соединение железа с кислородом, как, например, в оксидах железа. В таких соединениях положительно заряженные ионы железа притягивают отрицательно заряженные ионы кислорода, что обеспечивает устойчивость молекулы.
Ковалентная связь в железе образуется при обмене электронами между двумя атомами железа. Примером ковалентной связи в железе является образование железа-углеродного сплава. В таком сплаве атом углерода образует ковалентную связь с атомами железа, что значительно увеличивает прочность и твердость материала.
Металлическая связь в железе возникает за счет образования электронного облака, состоящего из свободных электронов, которые образуют общее электронное облако для всех атомов железа в материале. Примерами металлической связи в железе являются металлические сплавы, такие как сталь. В таких сплавах электронное облако обеспечивает проводимость электрического тока и тепло, а также способность к легированию и формированию кристаллической структуры.
Роль типов связи в свойствах железа
Железо является одним из самых распространенных и важных металлов в природе. Его свойства определяются типами химических связей, которые присутствуют в его структуре - ионной, ковалентной и металлической связями.
Ионная связь играет важную роль в свойствах железа. В данном случае, электроны переносятся от одного атома к другому, образуя положительно и отрицательно заряженные ионы. Именно такое соединение позволяет достичь высокой твердости и прочности металла, а также обеспечивает его хорошую теплопроводность.
Ковалентная связь в железе также играет важную роль. В этом случае, атомы железа делят свои электроны с другими атомами, образуя сильные связи между собой. Ковалентная связь обуславливает прочность и тугоплавкость железа, а также его устойчивость к окислению.
Металлическая связь является ключевой в свойствах железа. В данном случае, электроны перемещаются свободно и могут передаваться от одного атома к другому без препятствий. Такая связь обеспечивает высокую электропроводность и термопроводность железа, а также его способность к деформации и прочности.
Таким образом, типы химической связи в железе играют важную роль в его свойствах. Ионная связь обеспечивает прочность и твердость, ковалентная - устойчивость и тугоплавкость, а металлическая - электропроводность и деформационные свойства. Все эти связи работают вместе, чтобы обеспечить железу ее уникальные характеристики и широкое применение в различных областях промышленности и науки.
Вопрос-ответ

Какие типы химической связи существуют в железе?
В железе существуют три типа химической связи: ионная, ковалентная и металлическая.
Чем характеризуется ионная связь в железе?
Ионная связь в железе характеризуется переносом электронов между атомами. Атомы железа образуют положительные ионы Fe^2+ или Fe^3+, которые притягивают отрицательно заряженные ионы из других элементов.
Как проявляется ковалентная связь в железе?
Ковалентная связь в железе проявляется в распределении электронов между атомами железа и атомами других элементов. Атомы железа образуют ковалентные связи, обмениваясь электронами с другими атомами.
Чем характеризуется металлическая связь в железе?
Металлическая связь в железе характеризуется общими электронами, свободно перемещающимися между атомами железа. Это создает силу притяжения между атомами и обеспечивает характерные свойства металлов, такие как хорошая проводимость тепла и электричества.
Какие свойства металлов обусловлены металлической связью в железе?
Металлическая связь в железе обеспечивает характерные свойства металлов, такие как высокая теплопроводность и электропроводность, пластичность и малая твердость. Это связано с возможностью свободного движения электронов между атомами железа.
