Ковалентная химическая связь является одной из основных форм взаимодействия между атомами веществ. В большинстве случаев такая связь образуется между атомами неметаллов. Однако оказывается, что ковалентная связь может существовать и между атомами металлов, несмотря на наличие у них различных электронных свойств.
Ковалентная связь между атомами металлов имеет свои особенности, в отличие от связи между атомами неметаллов. Например, металлы имеют большое количество электронов в своих внешних энергетических оболочках, что делает их способными к образованию не только ионных, но и ковалентных связей.
Ковалентная связь между атомами металлов играет важную роль в многих областях научных исследований и практического применения. Например, эта связь может быть использована для создания материалов с уникальными свойствами, таких как сплавы с особым термическим или электрическим поведением. Также ковалентная связь между металлами может быть использована в каталитических процессах, где она играет важную роль в активации реагентов и образовании промежуточных состояний.
Ковалентная химическая связь: особенности и применения
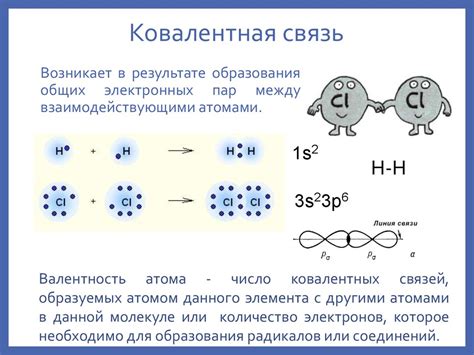
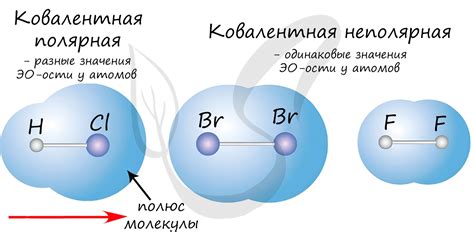
Ковалентная химическая связь - это связь между атомами, в которой пара электронов общая для обоих атомов. Особенностью ковалентной связи является то, что она образуется между двумя неметаллическими атомами, которые имеют высокую электроотрицательность и способность привлекать электроны.
Ковалентная связь имеет несколько основных особенностей. Во-первых, электроны в ковалентной связи делятся между двумя атомами, создавая сильную связь между ними. Это обычно приводит к образованию молекул, в которых атомы становятся стабильными за счет общего количества электронов.
Во-вторых, силу ковалентной связи можно регулировать путем изменения длины и угла связи между атомами. Это позволяет контролировать свойства вещества, такие как прочность, пластичность и теплопроводность. Например, ковалентные связи в алмазе обладают высокой прочностью благодаря кристаллической структуре.
Ковалентные связи широко используются в различных областях науки и технологий. В химии они играют важную роль в синтезе органических и неорганических соединений. В биологии ковалентные связи участвуют в формировании белков и ДНК, обеспечивая их структуру и функцию.
Одно из главных применений ковалентных связей - это создание полупроводников, которые используются в электронике и солнечных батареях. Ковалентные связи также используются при создании лекарств и материалов со специфическими свойствами, как, например, керамика, стекло и волокна.
Металлическая структура и ее характеристики
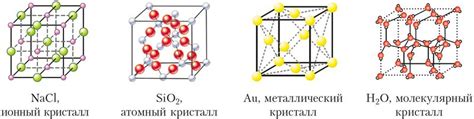
Металлическая структура – особенная форма атомной упаковки, присущая металлам и характеризующаяся наличием сетки кристаллических ячеек. Основными чертами металлической структуры являются высокая подвижность атомов и отсутствие определенного порядка и расположения атомов. Формируя решетку, атомы металлов образуют кристаллы, которые могут быть организованы в различные сетки.
Металлическая структура обладает рядом характеристик, которые определяют ее свойства. Во-первых, атомы металлов располагаются в кристаллической решетке близко друг к другу, образуя плотную структуру. В результате этого металлы обладают высокой плотностью и отличаются от других типов связей. Кроме того, металлическая структура обеспечивает высокую электрическую и теплопроводность металлов.
Металлическая структура также обладает способностью к деформации. Металлы могут быть изгибаемыми, расплавленными, волокнистыми и прочными. Это связано с характером связи между атомами в металлической структуре – электроны образуют общий "облако", которое позволяет атомам смещаться и поддаваться воздействию внешних сил.
Металлическая структура имеет также важное применение в различных областях. Например, благодаря своим свойствам, металлы широко используются в строительстве, производстве транспортных средств, электронике и машиностроении. Металлы также используются в процессах катализа, в производстве электроники, а также в промышленности, где требуется высокая прочность и стойкость к различным воздействиям.
Роль электронов в ковалентной связи
Электроны играют важную роль в образовании и поддержании ковалентной связи между металлами. Ковалентная связь основана на совместном использовании электронов, что позволяет металлам установить стабильное соединение.
В ковалентной связи электроны переносятся от одного атома к другому, образуя пары электронов, которые общаются с ядрами атомов, создавая электронное облако, связывающее металлы. Электроны играют роль "клея", который объединяет атомы металлов в ковалентную сеть.
Чтобы электроны могли образовать ковалентную связь между металлами, они должны быть достаточно подвижными и обладать свободой передвижения. Поэтому осуществление ковалентной связи возможно только в проводящих металлах, где электроны могут свободно двигаться по атомам.
Роль электронов в ковалентной связи проявляется и в электропроводности металлов. Благодаря наличию свободных электронов, которые могут двигаться под воздействием электрического поля, металлы обладают хорошей электропроводностью и могут служить материалами для изготовления проводников и электрических контактов.
Особенности ковалентной связи у металлов

Ковалентная связь – один из основных типов химической связи, которую могут образовывать металлы. В отличие от ионной связи, при ковалентной связи электроны делятся между атомами. Особенностью ковалентной связи у металлов является наличие свободных электронов в их валентной оболочке. Эти свободные электроны образуют так называемое «море электронов», которое связывает атомы металла в твердом состоянии.
Море электронов придает металлам такие свойства, как электропроводность, теплопроводность и металлический блеск. Электроны в море электронов локализованы и могут свободно двигаться внутри металла, что обеспечивает электропроводность. Кроме того, электроны также переносят тепло, поэтому металлы являются хорошими теплопроводниками.
Особенностью ковалентной связи у металлов являются также их механические свойства. Металлы обладают высокой пластичностью и способностью к деформации без разрушения. Это объясняется наличием моря электронов, которое позволяет атомам сдвигаться друг относительно друга без нарушения связей между ними. Поэтому металлы могут быть легко превращены в проволоку или листы.
Применение ковалентной связи в технологиях
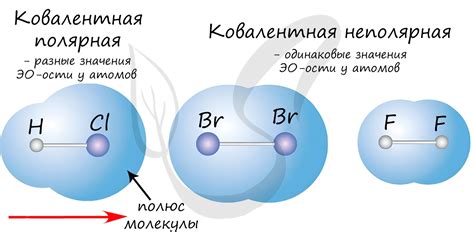
Ковалентная связь между металлами играет важную роль в различных технологиях. Она позволяет создавать прочные материалы с желаемыми механическими свойствами. Например, в аэрокосмической промышленности ковалентная связь используется для создания легких и прочных сплавов, которые обладают высокой коррозионной стойкостью и способны выдерживать экстремальные условия во время полета.
Ковалентная связь также применяется в электронике. Она позволяет создавать полупроводниковые материалы, которые имеют специфические электрические свойства. К примеру, при создании полупроводниковых чипов в процессе литографии наносится тонкий слой кремния, в котором атомы металла образуют ковалентные связи, обеспечивая проводимость электричества в нужных зонах.
В каталитической химии ковалентная связь используется для создания катализаторов, ускоряющих химические реакции. Например, в процессе гидрогенирования нефти используется катализатор на основе металлов с ковалентными связями, что позволяет повысить эффективность процесса и уменьшить затраты.
Ковалентная связь также применяется в производстве биологически активных веществ. В медицине, например, используются лекарственные препараты, содержащие молекулы с ковалентными связями, которые обеспечивают устойчивость препарата в организме и его длительное действие.
Таким образом, ковалентная связь между металлами имеет широкое применение в различных технологиях, позволяя создавать прочные материалы, ускорять химические реакции, производить полупроводники и производить биологически активные вещества.
Выдающиеся примеры ковалентной связи в металлах
Ковалентная химическая связь, характерная для неметаллов, отличается от ионной или металлической связи. Тем не менее, есть несколько выдающихся примеров ковалентной связи, которые возникают в металлах.
Один из таких примеров - образование комплексных соединений. Комплексные соединения образуются, когда атомы металла образуют донор-акцепторные связи с другими атомами или группами атомов. Примером такого соединения может служить комплекс железа с цианидными ионами. В этом комплексе атомы железа образуют ковалентную связь с атомами цианида.
Еще одним выдающимся примером ковалентной связи в металлах является образование металлокластеров. Металлокластеры представляют собой кластерные соединения, в которых атомы металла связаны ковалентными связями. Примером металлокластера может служить алюминийсодержащий кластер Al13. В этом кластере атомы алюминия образуют ковалентные связи между собой.
Также можно отметить образование металлоорганических соединений, в которых ковалентная связь возникает между атомами металла и органическими группами. Примером такого соединения может служить комплекс платины с органическими лигандами. В этом комплексе атомы платины образуют ковалентные связи с органическими группами.
Таким образом, выдающиеся примеры ковалентной связи в металлах включают образование комплексных соединений, металлокластеров и металлоорганических соединений. Эти связи могут быть важными для понимания и применения металлов в различных областях науки и технологий.
Вопрос-ответ

Каковы основные особенности ковалентной химической связи?
Ковалентная химическая связь возникает между атомами, которые делят одну или несколько пар электронов. В такой связи электроны больше не принадлежат отдельным атомам, а образуют общую электронную оболочку. Ковалентную химическую связь можно наблюдать в молекулах и кристаллах.
Каковы применения ковалентной химической связи между металлами?
Ковалентная связь между металлами имеет много применений в различных областях. Например, такие связи формируют структуру кристаллов металлов, что делает их прочными и твердыми. Ковалентные связи также могут использоваться для создания специальных металлических сплавов с улучшенными свойствами, такими как прочность, устойчивость к коррозии и магнитные свойства.
Все металлы образуют ковалентную химическую связь?
Не все металлы образуют ковалентную химическую связь. В основном, металлы имеют металлическую связь, которая возникает при обмене свободных электронов между атомами металла. Однако, в некоторых случаях, металлы также могут образовывать ковалентные связи с другими элементами, например, в молекулах комплексных соединений или в твердом состоянии некоторых металлических кристаллов.
