Кислотные оксиды - это соединения, содержащие кислород и образующиеся при окислении элементов. Они являются сильными окислителями, способными взаимодействовать с различными веществами. Однако, не все кислотные оксиды реагируют с металлами.
Реакция металлов с кислотными оксидами зависит от активности металла и его способности образовывать стабильные оксиды. Некоторые металлы, такие как калий, натрий, магний и алюминий, активно реагируют с кислотными оксидами, образуя соли с соответствующими кислотами. Например, магний реагирует с оксидом серы с образованием сульфата магния и выделением тепла.
Однако, некоторые металлы не реагируют с кислотными оксидами из-за своей низкой активности. Такие металлы, как железо, медь и цинк, не проявляют химической реакции с кислотными оксидами в обычных условиях. Например, цинк не реагирует с оксидом азота (II), образуя нитрат цинка. Это связано с тем, что нитрат является более стабильным оксидом, чем оксид азота (II).
Таким образом, реакция кислотных оксидов с металлами зависит от активности металла и его способности образовывать стабильные оксиды. Некоторые металлы активно реагируют, образуя соли, в то время как другие металлы не образуют химическую реакцию из-за своей низкой активности.
Химические реакции металлов с кислотными оксидами

Кислотные оксиды представляют собой соединения, образуемые при соединении кислорода с элементами, обладающими положительным окислением. Эти оксиды реагируют с металлами, что может приводить к различным химическим реакциям.
Возможна следующая реакция: при взаимодействии кислотных оксидов с металлами образуется соответствующий металлический оксид и кислота. Такие реакции могут быть очень активными и сопровождаются выделением значительного количества тепла и образованием газов.
Одним из примеров такой реакции является взаимодействие металла алюминия с кислотным оксидом серы (СО₂). При этом образуется оксид алюминия (Al₂O₃) и сернистая кислота:
- Al + SO₂ → Al₂O₃ + H₂SO₃
Это пример обратимой реакции, которая может протекать в обе стороны в зависимости от условий.
Из данного примера видно, что металлический оксид образуется при реакции с кислотным оксидом и может принимать участие в дальнейших химических процессах, например, взаимодействовать с водой, чтобы образовать гидроксид металла.
В общем случае, химические реакции металлов с кислотными оксидами могут быть очень разнообразными и зависеть от конкретных условий и веществ, участвующих в реакции.
Кислотные оксиды и их свойства
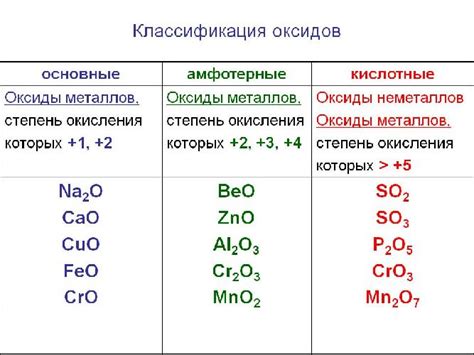
Кислотные оксиды – это химические соединения, состоящие из кислорода и неосновного элемента, который может быть металлом или полуметаллом. Основным свойством кислотных оксидов является их способность образовывать кислоты при реакции с водой.
Кислотные оксиды сильно реакционны и обладают высокой кислотностью. Они способны образовывать кислотные растворы, которые имеют кислотные свойства, такие как кислотный вкус, способность изменять цвет индикаторов и реагировать с основаниями.
При контакте кислотных оксидов с водой происходит реакция, в результате которой образуется кислота и высвобождается энергия. Такие реакции называются гидратацией. Гидратация кислотных оксидов - экзотермический процесс, сопровождающийся выделением тепла.
Некоторые кислотные оксиды, такие как оксид серы, оксид азота и оксидуглерода, обладают также ярко выраженными окислительными свойствами. Именно они являются причиной проявления взрывоопасности данных веществ.
Кислотные оксиды могут реагировать с металлами, образуя соли. При этом происходит обмен ионами: кислотный оксид выступает в роли кислотного компонента, а металл – в роли основания. Реакция между кислотными оксидами и металлами носит окислительно-восстановительный характер и может сопровождаться выделением газов, плавающих масс (осадков) или изменением цвета раствора.
Таким образом, кислотные оксиды являются важными и активными соединениями, которые обладают высокой кислотностью и способностью образовывать кислоты при контакте с водой. При взаимодействии с металлами они могут вызывать окислительно-восстановительные реакции и образование солей. Эти химические свойства делают кислотные оксиды неотъемлемой частью многих химических процессов и могут использоваться в промышленности и научных исследованиях.
Реакция неактивных металлов с кислотными оксидами
Неактивные металлы, такие как золото, платина и серебро, реагируют с кислотными оксидами весьма медленно и слабо. Это связано с тем, что эти металлы обладают высокой устойчивостью к химическим реакциям и показывают низкую активность во взаимодействии с другими веществами.
При контакте с кислотными оксидами, неактивные металлы могут лишь незначительно окисляться, не претерпевая серьезных изменений. Такие реакции обычно протекают медленно и показывают низкую интенсивность. В результате образуется тонкая пленка оксида металла на поверхности неактивного металла, которая может защищать его от дальнейшего взаимодействия с окружающими веществами.
Однако, не всегда реакция неактивных металлов с кислотными оксидами полностью отсутствует. В ряде случаев, при наличии определенных условий, может происходить частичное окисление неактивного металла. Например, при повышенной температуре или в условиях наличия катализаторов, реакция между неактивными металлами и кислотными оксидами может протекать с большей интенсивностью.
Таким образом, можно сказать, что в общем случае реакция неактивных металлов с кислотными оксидами является медленной и слабой. Но при определенных условиях и в особых ситуациях, эта реакция может протекать с большей активностью и интенсивностью. Важно учитывать все факторы, влияющие на химическую реакцию, при изучении взаимодействия неактивных металлов с кислотными оксидами.
Влияние активности металлов на реакцию с кислотными оксидами
Реакция металлов с кислотными оксидами может протекать или не протекать в зависимости от активности самого металла. Активность металлов связана с их способностью образовывать ионные соединения с кислородом, что определяет их реакционную способность в различных окружающих условиях.
Наиболее активные металлы, такие как литий, натрий и калий, быстро реагируют с кислотными оксидами. Например, литий реагирует с оксидом серы, образуя сульфат лития и выделяя при этом тепло:
2Li + SO2 → Li2SO4
Менее активные металлы, такие как медь и серебро, не реагируют с кислотными оксидами в обычных условиях и требуют более высоких температур или других условий для инициирования реакции. Например, медь реагирует с оксидом азота только при нагревании:
Cu + 2NO → CuO + 2NO2
Некоторые металлы, такие как железо и алюминий, имеют умеренную активность и реагируют с кислотными оксидами при комнатной температуре. Например, железо реагирует с оксидом углерода, образуя оксид железа:
Fe + CO2 → FeO + CO
Влияние активности металлов на реакцию с кислотными оксидами связано с энергией и стабильностью получаемых соединений. Более активные металлы имеют большую энергию связи с кислородом и легко образуют стабильные ионные соединения. Наоборот, менее активные металлы имеют меньшую энергию связи и более слабую способность образовывать ионные соединения.
Особенности реакции алюминия и железа с кислотными оксидами

Реакция алюминия и железа с кислотными оксидами представляет особый интерес в химии. Эти металлы обладают способностью вступать в реакцию с различными оксидами, что объясняется их химической активностью и амфотерностью.
Алюминий, являясь амфотерной основой, реагирует с кислотными оксидами, образуя соли алюминия и выделяя воду. Например, реакция алюминия с оксидом серы (IV) приводит к образованию сульфата алюминия и выделению воды:
- Al + SO2O4 → Al2(SO4)3 + H2O
Железо, в свою очередь, также проявляет свою амфотерность при реакции с кислотными оксидами. Однако, в отличие от алюминия, оно образует соли двухвалентного железа. Например, реакция железа с оксидом серы (VI) приводит к образованию сульфата железа (II) и выделению воды:
- Fe + SO3 → FeSO4 + H2O
Таким образом, реакция алюминия и железа с кислотными оксидами является характерной чертой их химического поведения и позволяет проводить дальнейший анализ и изучение этих элементов в химических процессах.
Факторы, влияющие на протекание реакции металлов с кислотными оксидами

1. Активность металла. Протекание реакции металлов с кислотными оксидами зависит от активности металлов. Чем выше активность металла, тем быстрее и интенсивнее протекает реакция. Например, реакция цинка с оксидом серы (IV) протекает очень быстро, так как цинк является активным металлом.
2. Концентрация кислотного оксида. Концентрация кислотного оксида влияет на скорость протекания реакции. Чем больше концентрация кислотного оксида, тем быстрее протекает реакция. Например, реакция алюминия с оксидом азота (V) протекает быстро при высокой концентрации оксида азота.
3. Режим реакции. Режим реакции также влияет на протекание реакции металлов с кислотными оксидами. Если реакция проводится при повышенной температуре, то она протекает быстрее. Также, увеличение поверхности металла (например, в виде порошка или стружки) может ускорить реакцию.
4. Положение металла в ряду активности. Положение металла в ряду активности также влияет на протекание реакции. Если металл находится выше кислотного оксида в ряду активности, то реакция протекает. Если металл находится ниже кислотного оксида в ряду активности, то реакция не протекает.
5. Свойства кислотного оксида. Свойства кислотного оксида, такие как кислотность и степень окисления, могут влиять на протекание реакции с металлами. Кроме того, на протекание реакции может оказывать влияние и природа кислотного оксида - некоторые оксиды обладают высокой реактивностью и могут способствовать протеканию реакции даже с менее активными металлами.
Вопрос-ответ

Что такое кислотные оксиды?
Кислотные оксиды или оксиды неметаллов — это вещества, состоящие из оксида неметалла и кислорода. Они обладают кислотными свойствами и реагируют с основаниями, образуя соли и воду.
Протекает ли реакция кислотных оксидов с металлами?
Реакция кислотных оксидов с металлами может протекать при определенных условиях. Некоторые кислотные оксиды могут образовывать с металлами соли и выделять воду. Однако, не все кислотные оксиды реагируют с металлами, и реакция может быть зависима от конкретных условий и свойств оксида и металла.
Какие условия необходимо для протекания реакции кислотных оксидов с металлами?
Для протекания реакции кислотных оксидов с металлами необходимо обеспечить контакт между оксидом и металлом, а также подходящие условия для реакции, такие как определенная температура и наличие растворителя или катализатора. Кроме того, реакция может зависеть от конкретных свойств оксида и металла, таких как их электрохимические свойства и способность образовывать соединения.
