Диссоциация электролитов является одним из ключевых процессов в химии. Она заключается в разделении молекулы электролита на ионы, что позволяет ему проявлять свойства проводимости электрического тока. В данной статье мы рассмотрим диссоциацию электролитов с образованием катиона металла на примере нескольких соединений: гидроксида натрия (NaOH), оксида железа (FeO) и азотной кислоты (HNO3).
Гидроксид натрия (NaOH) является одним из наиболее распространенных и хорошо изученных электролитов. При диссоциации данного соединения в водном растворе образуются ионы натрия (Na+) и гидроксида (OH-). Именно наличие ионов гидроксида определяет щелочные свойства этого вещества. Гидроксид натрия широко применяется в различных областях, включая промышленность, бытовые и медицинские цели.
Оксид железа (FeO) — это еще одно важное соединение металла, диссоциирующее с образованием катиона. Данное вещество представляет собой черный порошок, который может реагировать с кислородом, образуя оксид (Fe2O3) или даже триоксид (Fe3O4). При распаде оксида железа (FeO) на ионы образуется катион железа (Fe2+), который имеет важное значение в металлургии и других областях применения.
Азотная кислота (HNO3) является сильной минеральной кислотой, которая также может диссоциировать с образованием катиона. В данном случае, при диссоциации азотной кислоты, образуются ионы водорода (H+) и нитратных (NO3-) групп. Азотная кислота широко используется в химической промышленности и лабораторных исследованиях.
Определение диссоциации электролита
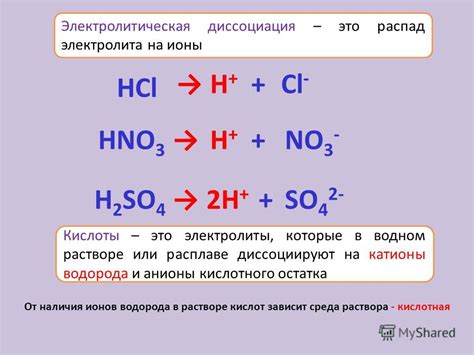
Диссоциация электролита – это процесс разделения молекул или ионов вещества на ионы в растворе под воздействием растворителя или при повышенной температуре. В результате диссоциации образуются положительно и отрицательно заряженные ионы.
Вещества, способные диссоциировать при взаимодействии с водой или другим растворителем, называют электролитами. Диссоциация электролитов осуществляется с образованием ионов разного знака – катионов и анионов.
Процесс диссоциации можно показать с помощью химических уравнений. Например, NaOH – это основание, которое диссоциирует в воде, образуя ион натрия (Na+) и гидроксидный ион (OH-).
Важной характеристикой диссоциации электролита является его степень диссоциации – это отношение числа диссоциировавших молекул или ионов к общему числу вещества в растворе. Степень диссоциации может быть выражена в процентах или долях.
На примере электролитов, таких как NaOH, FeO и HNO3, можно наблюдать процесс диссоциации с образованием катионов металла. Эти вещества диссоциируют в воде с образованием ионов натрия, железа и азота соответственно.
Роль катионов металла в диссоциации электролита

Катионы металла играют важную роль в процессе диссоциации электролита, так как их наличие обуславливает возможность образования электрического заряда в растворе. В случае рассмотренных примеров - NaOH, FeO и HNO3 - каждый из них диссоциирует с образованием определенного катиона металла.
Например, электролит NaOH диссоциирует на ионы натрия (Na+) и гидроксильные ионы (OH-). Катион натрия определяет положительный заряд и влияет на электролитические свойства раствора. Столь же важная роль приходится на гидроксильные ионы, которые определяют щелочные свойства раствора и являются активными участниками химических реакций.
Катионы металла также играют роль в диссоциации электролита FeO. В данном случае ионная формула диссоциированного электролита содержит катион железа II (Fe2+), который в растворе образует стабильные соединения и способствует проявлению его электролитических свойств.
В случае электролита HNO3, происходит диссоциация на ионы водорода (H+) и ионы нитрата (NO3-). Здесь катион водорода определяет кислотные свойства раствора и является активным участником химических реакций.
Таким образом, катионы металла вносят значимый вклад в диссоциацию электролита, определяя его электролитические свойства и способность участвовать в химических реакциях. Диссоциация электролитов с образованием катиона металла имеет большое значение во многих процессах, включая химическую промышленность и жизнедеятельность организмов.
Примеры диссоциации с образованием катиона металла

1. Диссоциация NaOH: При растворении гидроксида натрия (NaOH) в воде происходит диссоциация сообразно реакции: NaOH → Na+ + OH-. В результате образуется катион натрия Na+ и гидроксидное ионное радикал OH-, который является основным компонентом щелочных растворов.
2. Диссоциация FeO: Железо(II) оксид (FeO) тоже может диссоциировать в растворе. При этом образуются катион железа Fe2+ и анион оксида O2-. Данная реакция представляется следующим образом: FeO → Fe2+ + O2-. Это является одной из основных реакций, которые протекают при взаимодействии железа и кислорода.
3. Диссоциация HNO3: Диссоциация азотной кислоты (HNO3) происходит в водном растворе по следующей реакции: HNO3 → H+ + NO3-. В результате образуется катион водорода H+ и анион нитрата NO3-. Азотная кислота является сильной кислотой и часто используется в химических реакциях и в процессе получения различных соединений.
Таким образом, диссоциация электролита с образованием катиона металла является распространенным явлением в химии. Эти примеры диссоциации демонстрируют растворимость соответствующих веществ и образование ионных радикалов, что имеет важное значение не только для понимания процессов происходящих в растворах, но и для применения данных соединений в различных отраслях науки и техники.
Наиболее известные примеры: NaOH, FeO, HNO3

Диссоциация электролита с образованием катиона металла является важным процессом в химии. Один из наиболее известных примеров такой диссоциации - это соединение NaOH, или гидроксид натрия. При растворении в воде NaOH диссоциирует на катионы натрия (Na+) и анионы гидроксида (OH-), что делает его сильным щелочным электролитом.
Другой пример - FeO, или окись железа. Это соединение имеет катион железа (Fe2+) и анион оксида (O2-). При растворении в воде FeO диссоциирует, освобождая катион железа и анион оксида, что делает его слабым основанием.
Вещество HNO3, или азотная кислота, также проявляет диссоциацию с образованием катиона металла. HNO3 растворяется в воде, образуя катионы водорода (H+) и анионы нитрата (NO3-). Азотная кислота является сильным кислотным электролитом.
Все эти примеры демонстрируют процесс диссоциации электролита, при котором соединение разделяется на ионы, обеспечивая электролитическую проводимость раствора и проявляя химическую активность.
Вопрос-ответ

Какая роль играет диссоциация электролита в образовании катиона металла?
Диссоциация электролита – это процесс распада электролита на ионы в растворе. В случае образования катиона металла, диссоциация электролита позволяет освободить катионы металла, которые реагируют со средой и проявляют свои химические свойства.
Как происходит диссоциация электролита NaOH?
При растворении NaOH в воде происходит диссоциация молекул NaOH на ионы Na+ и OH-. В результате образуются гидроксид и катионы натрия, которые могут реагировать с другими веществами в растворе.
Как образуется катион Fe2+ в соединении FeO?
Катион Fe2+ образуется в результате диссоциации соединения FeO в растворе. При растворении FeO в воде любые молекулы FeO распадаются на ионы Fe2+ и O2-. Таким образом, образуется катион металла Fe2+, который может проявить свои свойства в реакциях со средой.
Как образуется катион H+ в соединении HNO3?
Катион H+ образуется в результате диссоциации соединения HNO3 в растворе. При растворении HNO3 в воде происходит распад молекулы HNO3 на ионы H+ и NO3-. Таким образом, образуется катион водорода, который может осуществлять химические реакции с другими веществами в растворе.
Какие еще примеры диссоциации электролита с образованием катиона металла можно назвать?
Помимо NaOH, FeO и HNO3, примерами диссоциации электролита с образованием катиона металла являются такие соединения, как MgCl2 (Mg2+), CuSO4 (Cu2+), KCl (K+), Ba(OH)2 (Ba2+), и многие другие.
